|
Trichlorure d'antimoine
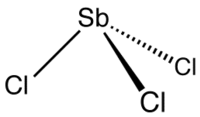
Le trichlorure d'antimoine est un composé chimique moléculaire de formule brute SbCl3. C'est un solide mou sans couleur qui était connu comme beurre d'antimoine par les alchimistes. Il a une odeur forte, et, au contact de l'eau, il s'hydrolyse formant de l'oxychlorure et dégageant du chlorure d'hydrogène. Ainsi, les échantillons de SbCl3 doivent être protégés de l'humidité : SbCl3 forme des complexes avec le chlore par exemple: SbCl52−. Structure cristalline
Le trichlorure d'antimoine cristallise dans une structure orthorhombique de groupe d'espace Pnma (a = 8,111 Å, b = 9,419 Å et c = 6,313 Å). Les atomes d'antimoine occupent les positions de Wyckoff 4c (x = 0.490, z = 0.475) et les atomes de chlore les positions 4c (x = 0.072 et z = 0.669) et 8d (x = 0.176, y = 0.071 et z = 0.134), formant des pyramides SbCl3 [4]. UsagesSbCl3 est un réactif pour la détection de la vitamine A et des autres caroténoïdes dans le test de Carr-Price. Le trichlorure d'antimoine réagit avec les caroténoïdes pour former un complexe bleu qui peut être mesuré par colorimétrie. Le trichlorure d'antimoine a été utilisé pour simuler l'effet trouble de l'absinthe. Il est aussi utilisé comme catalyseur pour des réactions de polymérisation, de craquage et de chloration ; comme mordant et dans la production d'autres sels d'antimoine. Ses solutions sont utilisées comme réactif chimique pour le chloral, les aromatiques et la vitamine A. Notes et références
Information related to Trichlorure d'antimoine |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||