|
Аминотрансферазы Аминотрансфера́зы (трансаминазы) — ферменты из группы трансфераз, катализирующие перенос аминогрупп от аминокислот на кетокислоты без образования свободного аммиака. Эти реакции трансаминирования осуществляют связь между белковым и углеводным обменом. Аминотрансферазы также называют трансаминазами, а реакцию — трансаминированием. Ферменты относятся к подклассу КФ 2.6. Биохимические реакции аминотрансферазДля аминотрансфераз донором аминогрупп являются аминокислоты, а акцептором — кетокислоты: AK1 + KK2 ↔ KK1 + AK2 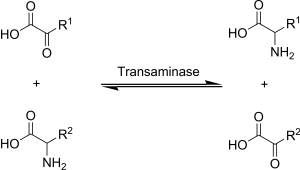 В составе простетической группы аминотрансферазы содержат производные витамина B6. Во время переноса аминогруппы простетическая группа переходит из пиридоксаль-5-фосфатной формы в пиридосамино-5-фосфатную форму. Механизм реакции трансаминирования (переаминирования) открыт в 1937 году советскими учеными А. Е. Браунштейном и М. Г. Крицман[1][2]. Процесс протекает в две стадии.
Аминотрансферазы являются каталитически совершенными ферментами. Аминотрансферазы содержатся практически во всех органах, но наиболее активно реакции трансаминирования идут в печени. К этой группе ферментов относятся используетмые в клинической лабораторной диагностике ферменты аспартатаминотрансфераза (АСТ) и аланинаминотрансфераза (АЛТ). Эти фeрменты были открыты в 1954 году, а в 1955 описана их роль в организме и значение для клинической диагностики[3]. Примечания
Литература
|