|
Фруктозо-1,6-бисфосфатаза
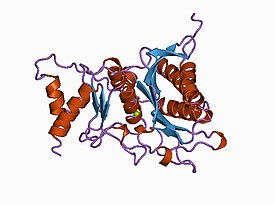
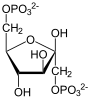
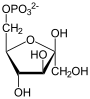
Фруктозо-1,6-бисфосфатаза, также Фруктозо-1,6-дисфосфатаза (ФБФ-аза, FBP сокр. от англ. Fructose 1,6-bisphosphatase, шифр КФ 3.1.3.11) — фермент из группы фосфатаз (класс гидролазы), катализирующий реакцию гидролиза фруктозо-1,6-бисфосфата до фруктозо-6-фосфата с образованием неорганического фосфата по реакции: Данная реакция протекает в глюконеогенезе и цикле Кальвина, которые относят к анаболическими процессами. Фруктозо-1,6-бисфосфатаза катализирует обратную реакцию, по отношению к реакции, катализируемой фосфофруктокиназой в процессе гликолиза[1][2]. Эти ферменты катализируют реакции только в одном направлении, и регулируются метаболитами, такими как фруктозо-2,6-бисфосфат, так что высокая активность одного из двух ферментов сопровождается низкой активностью другого. Известно, что фруктозо-2,6-бисфосфат способен также аллостерически связываться с фруктозо-1,6-бисфосфатазой, тем самым ингибируя её, но активирует при этом фосфофруктокиназу. ФБФ-аза участвует в различных метаболических путях и встречается у большинства организмов. ФБФ-азе для катализа в качестве кофакторов требуются ионы двухвалентных металлов (предпочтительнее Мg2+ и Мn2+), при этом ионы лития Li+ являются мощными ингибиторами. Ген, кодирующий данные фермент — FBP1, локализован на 9-й хромосоме. СтруктураБыло отмечено, что фолд фруктозо-1,6-бисфосфатазы свиньи идентичен инозитол-1-фосфатазе (ИМФ-азе)[3]. Инозитолполифосфат 1-фосфатаза (ИПФ-аза), ИМФ-аза и ФБФ-аза имеют мотив последовательности (Asp-Pro-Ile/Leu-Asp-Gly/Ser-Thr/Ser), который, как было показано, связывает ионы металлов и участвует в катализе. Этот мотив также встречается в дистанционно связанных грибковых, бактериальных и дрожжевых гомологах ИМФ-азы. Было высказано предположение, что эти белки определяют древнее структурно-консервативное семейство, вовлечённое в различные метаболические пути, включая сигнализацию инозитолом, глюконеогенез, усвоение сульфата и, возможно, метаболизм хинона[4]. Распределение видовТри различные группы фруктозо-1,6-бисфосфатазы были идентифицированы у эукариот и бактерий (ФБФ-азы I—III)[5]. Ни одна из этих групп до сих пор не была найдена в археях, однако, новая группа ФБФ-аз (ФБФ-азы IV), которая также проявляет свойства инозитол монофосфатазы, недавно выявлена у архей[6]. Новая группа ФБФ-аз (ФБФ-азы V) встречается в термофильных археях и гипертермофильных бактериях Aquifex aeolicus[7]. Участие в лечении диабетаФруктозо-1,6-бисфосфатаза также играет ключевую роль в лечении сахарного диабета 2 типа. Это заболевание характеризуется гипергликемией (повышенной концентрацией глюкозы в крови), которая вызывает множество серьёзных проблем, и в лечении часто приходится акцентировать внимание на снижение уровня сахара в крови[8][9][10]. Усиленный глюконеогенез в печени является одной из основных причин перепродукции глюкозы у этих больных, и поэтому ингибирование глюконеогенеза является разумным способом для лечения сахарного диабета 2 типа. ДефицитМутации в гене FBP1 могут приводить к наследственной недостаточности фруктозо-1,6-бисфосфатазы. Это аутосомно-рецессивное заболевание, характеризующееся нарушениям процесса глюконеогенеза, которые приводят к гипогликемии, лактатацидозу, гипервентиляции, судорогам и гипогликемической коме. Особенно опасны эти проявления среди новорождённых, так как среди них наблюдается высокая летальность. Примечания
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||