|
Nitrate de mercure(II)
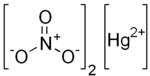
Le nitrate de mercure(II) est un composé inorganique de formule chimique Hg(NO3)2. C'est le sel de mercure(II) de l'acide nitrique HNO3. Il contient des cations mercure(II) Hg2+ et des anions nitrate NO3−, ainsi que de l'eau de cristallisation H2O dans le cas d'un sel hydraté. Le nitrate de mercure(II) forme des hydrates Hg(NO3)2*xH2O. Les sels anhydres et hydratés sont des solides cristallins incolores ou blancs solubles qui sont parfois utilisés comme réactifs. Le nitrate de mercure(II) est obtenu en traitant du mercure avec de l'acide nitrique concentré chaud. Ni le sel anhydre ni le monohydrate n'ont été confirmés par cristallographie aux rayons X[2]. Le sel anhdyre est plus fréquemment utilisé. UtilisationLe nitrate de mercure(II) est utilisé comme agent oxydant en synthèse organique, comme agent de nitrification, comme réactif analytique dans les laboratoires, dans la fabrication du feutre, et dans la fabrication du fulminate de mercure[3]. Une variante du test qualitatif de Zeisel peut être faite en utilisant du nitrate de mercure(II) au lieu du nitrate d'argent, ce qui conduit à la formation d'iodure de mercure(II) rouge écarlate[4]. Informations sur la santéLes composés du mercure sont hautement toxiques. L'utilisation de ce composé par les chapeliers et l'intoxication au mercure qui s'en est suivi est une théorie courante sur l'origine de l'expression "fou comme un chapelier". Références
Voir aussiArticles connexesLiens externes
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||